728x90
반응형
SMALL
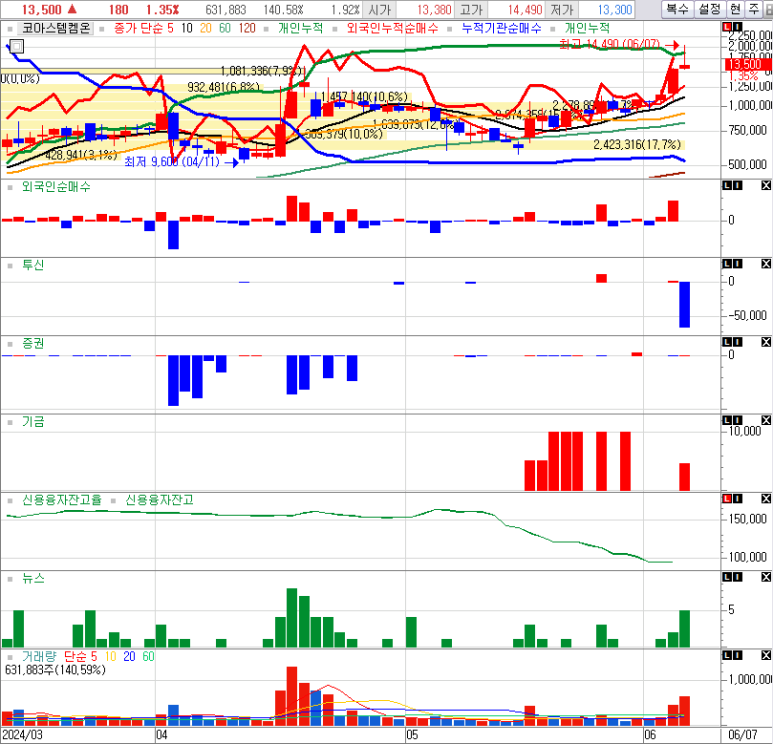
우리 기금이 바이오 좋아하는구나~
투자판단 관련 주요경영사항(임상시험 계획 승인 등 결정)
|
투자 유의사항
|
- 임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다.
- 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다.
- 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다.
|
|
|
1. 제목
|
항아쿠아포린4 항체 양성 시신경척수염 범주질환 환자에서 동종골수유래 중간엽줄기세포(CE211NS21)와 면역억제제(Immunosuppressive Therapy, IST)의 병용 치료 시 안전성 및 내약성을 평가하기 위한 1상 임상시험 계획 승인
|
|
|
2. 주요내용
|
1) 임상시험명칭
|
항아쿠아포린4 항체 양성 시신경척수염 범주질환 환자에서 동종골수유래 중간엽줄기세포(CE211NS21)와 면역억제제(Immunosuppressive Therapy, IST)의 병용 치료 시 안전성 및 내약성을 평가하기 위한 1상 임상시험
|
|
2) 임상시험단계
|
한국 식품의약품안전처(MFDS) 제1상
|
|
|
3) 임상시험승인기관
|
한국 식품의약품안전처(MFDS)
|
|
|
4) 임상시험실시국가
|
한국
|
|
|
5) 임상시험실시기관
|
한국 내 4개 병원
|
|
|
6) 대상질환
|
시신경 척수염
|
|
|
7) 신청일
|
2023-12-26
|
|
|
8) 승인일(결정일)
|
2024-06-05
|
|
|
9) 등록번호
|
20230222202
|
|
|
10) 임상시험 목적
|
본 임상시험은 항아쿠아포린 4 항체 양성 시신경척수염 범주질환(antiaquaporin-4-immunoglobulin G positive neuromyelitis optica spectrum disorder, AQP4-IgG-positive NMOSD) 환자를 대상으로 동종골수유래 중간엽줄기세포(CE211NS21)와 면역억제제(Immunosuppressive Therapy, IST)의 병용치료 시 안전성 및 내약성을 평가한다.
1. 일차목적
AQP4-IgG양성 시신경척수염 범주질환 환자를 대상으로 CE211NS21과 IST의 병용치료 시 안전성 및 내약성을 평가한다.
2. 이차목적
AQP4-IgG양성 시신경척수염 범주질환 환자를 대상으로 CE211NS21과 IST의 병용치료 시 유효성을 평가한다.
3. 탐색적 목적
AQP4-IgG양성 시신경척수염 범주질환 환자를 대상으로 CE211NS21과 IST의 병용치료 시 biomarker의 변화를 평가한다.
|
|
|
11) 임상시험 방법
|
본 임상시험은 AQP4-IgG 양성인 시신경척수염 범주질환(NMOSD) 환자를 대상으로 동종골수유래 중간엽줄기세포(CE211NS21)와 면역억제제(IST)의 병용치료 시 내약성, 안전성 및 유효성을 평가하는1 상 임상시험이다. 시험대상자가 본 임상시험에 참여할 것을 자의로 서면 동의하면, 임상시험계획서에 따라 선정/제외 기준에 부합여부를 확인한다.
CE211NS21주에 대한 최대 내약 용량(MTD)을 확인하기 위해 각 용량·증가 단계(코호트)에서 3-6명의 시험대상자로 이루어진 코호트가 평가된다. 각 코호트의 용량·증가에 대한 설계는 7.4 용량 단계 변경에 제시되었다. 1상 임상시험의 선정/제외 기준에 적합한 시험대상자는 베이스라인(D0), 4주 및 16주시점에 입원하여 IST 와 병용하여 CE211NS21을 뇌척수강 내 투여한다. CE211NS21 투여 시마다 투여 후 24시간 동안 급성 이상사례를 확인하고 첫번째 투여일로부터24주까지 내약성 및 안전성을 확인하기 위한 평가를 실시한다. 또한, CE211NS21 첫 투여 후 12주, 24주시점에 유효성을 평가한다.
1단계 용량 코호트에 첫 등록된 3명의 시험대상자는 최소 3일 간격으로 순차 등록하고 CE211NS21 1 회 투여 후 본 프로토콜에서 정의한 Dose Limited Toxicity (DLT)로써 NCI-CTCAE ver 5.0의 Grade 3 이상의 약물이상반응이 발생하지 않으면 이후 2단계 용량 코호트 3명을 순차적으로 등록하여 내약성 및 안전성을 평가한다. 단, 해당 단계 용량 코호트에서 CE211NS21 3회 투여 완료 이전에 DLT외의 이유로 중도탈락 할 경우 DLT 평가 대상자에서 제외되며, 동일 용량 단계로 새로운 시험대상자를 추가할 수 있다.
해당 단계 용량 코호트에서 만약 1명에서 DLT가 발생했거나 3명 중 한 명이라도 DLT를 경험한 경우, 해당 단계 용량으로 3명이 추가 배정된다. 만약 1단계 용량 코호트에서2명 혹은 그 이상에서 DLT가 발생하면 임상시험은 중단되며, 2단계 용량 코호트에서 2명 혹은 그 이상에서 DLT가 발생하면 1단계 용량이 MTD로 정의된다. 임상시험 기간 중 재발(relapse)한 대상자는 임상시험에서 중도 탈락하게 되며, 한 번이라도 CE211NS21을 투여 받은 시험대상자에 대하여 별도의 장기추적관찰연구를 통해 5년 동안의 안전성을 추적관찰 할 것이다.
|
|
|
12) 1차 지표
|
1차 지표 (안전성 평가변수)
1) 이상사례
2) 활력징후(좌위 수축기 및 이완기 혈압, 맥박, 호흡수, 체온, 체중)
3) 심전도(12-lead ECG)
4) 실험실검사(혈액학적/혈액화학적 검사, 소변검사, 뇌척수액 검사)
5) 신체검진
6) 흉부 X-ray
|
|
|
13) 1차 지표 통계분석방법
|
[이상사례]
MedDRA(Medical Dictionary for Regulatory Activities) 최신 버전을 이용하여 System Organ Class(SOC)와 Preferred Term(PT)에 따라 코드화하여 정리하고, 코드화된 이상사례의 발현 시험대상자 수, 발현율(%), 발현 건수를 제시하고 발현율에 대한 양측 95% 신뢰구간을 제시한다.
이상사례는 치료기간의 임상시험용 의약품 투여 이후 발생한 이상사례(Treatment-Emergent Adverse Event, TEAE)를 기준으로 분석하며, 이상사례(TEAE), 약물이상반응(Adverse Drug Reaction, ADR), 중대한 이상사례(Serious Adverse Event, SAE), 중대한 약물이상반응(Serious Adverse Drug Reaction, SADR), 용량제한독성(Dose Limited Toxicity, DLT)에 대해 요약한다.
[활력징후, 심전도 검사, 실험실검사, 신체검진, 흉부 X-ray]
활력징후, 심전도 검사, 실험실검사, 흉부 X-ray 검사 등과 같은 연속형 자료는 방문별로 기술통계량(평균, 표준편차, 중앙값, 최소값, 최대값)을 제시하며, 임상시험용 의약품 투여 전과 후의 변화량에 대한 군 내 검정은 paired t-test 또는 Wilcoxon signed rank test로 분석한다. 추가적으로, 실험실적 검사, 심전도 검사 및 신체검진 결과는 임상시험용 의약품 투여 전 ‘정상(Normal) 또는 임상적으로 유의하지 않은 비정상(NCS)’에서 임상시험용 의약품 투여 후 ‘임상적으로 유의한 비정상(CS)’으로 한번이라도 변화한 시험대상자에 대해 비율로 요약하고, 일람표를 제시한다
|
|
|
14) 임상시험기간
|
기관생명윤리위원회(IRB) 승인일로부터 36개월
|
|
|
15) 목표 시험대상자 수
|
6~12명
|
|
|
16) 예상종료일
|
2027-08-31
|
|
|
3. 사실발생(확인)일
|
2024-06-05
|
|
|
4. 기타 투자판단과 관련한 중요사항
|
||
|
- 상기 사실발생(확인)일은 한국 식품의약품안전처(MFDS)로부터 임상시험계획 승인을 통보 받은 날짜입니다.
- 상기 실험설계, 대상자 수 및 시험기관, 예상 종료일 등은 임상시험 진행 상황에 따라 변동될 수 있습니다.
- 공시 내용은 향후 당사의 보도자료 및 IR 자료로 사용될 예정입니다.
|
||
|
※ 관련공시
|
||
|
일자
|
종가
|
대비
|
거래량
|
개인
|
외국인
|
기관계
|
금융투자
|
투신
|
보험
|
은행
|
종금
|
연기금 등
|
사모펀드
|
내외국인
|
기타
|
|
|
2024/06/07
|
13,500
|
▲
|
180
|
631,883
|
-1,081
|
1,051
|
170
|
31
|
-772
|
0
|
0
|
96
|
747
|
68
|
14
|
-154
|
|
2024/06/05
|
13,320
|
▲
|
1,140
|
449,453
|
-1,557
|
134
|
1,699
|
31
|
110
|
0
|
0
|
0
|
684
|
874
|
0
|
-275
|
|
2024/06/04
|
12,180
|
▲
|
300
|
157,018
|
190
|
-915
|
999
|
32
|
102
|
0
|
0
|
0
|
684
|
182
|
6
|
-281
|
|
2024/06/03
|
11,880
|
▼
|
100
|
107,264
|
358
|
-1,083
|
999
|
32
|
102
|
0
|
0
|
0
|
684
|
182
|
9
|
-283
|
|
2024/05/31
|
11,980
|
▲
|
520
|
117,590
|
136
|
-861
|
999
|
32
|
102
|
0
|
0
|
0
|
684
|
182
|
9
|
-283
|
|
2024/05/30
|
11,460
|
▼
|
150
|
81,823
|
254
|
-935
|
949
|
-18
|
102
|
0
|
0
|
0
|
684
|
182
|
10
|
-278
|
|
2024/05/29
|
11,610
|
▼
|
270
|
117,090
|
322
|
-885
|
833
|
-18
|
102
|
0
|
0
|
0
|
568
|
182
|
9
|
-279
|
|
2024/05/28
|
11,880
|
▲
|
460
|
231,840
|
-12
|
-617
|
899
|
-18
|
102
|
0
|
0
|
0
|
568
|
248
|
8
|
-279
|
|
2024/05/27
|
11,420
|
▼
|
120
|
111,888
|
976
|
-1,376
|
661
|
-18
|
-18
|
0
|
0
|
0
|
451
|
248
|
13
|
-274
|
|
2024/05/24
|
11,540
|
▲
|
30
|
153,309
|
823
|
-1,217
|
661
|
-18
|
-18
|
0
|
0
|
0
|
451
|
248
|
14
|
-281
|
|
2024/05/23
|
11,510
|
▲
|
620
|
164,215
|
1,016
|
-1,013
|
314
|
-18
|
-18
|
0
|
0
|
0
|
335
|
16
|
13
|
-331
|
|
2024/05/22
|
10,890
|
▼
|
430
|
118,798
|
1,132
|
-791
|
-24
|
-18
|
-18
|
0
|
0
|
0
|
223
|
-210
|
11
|
-328
|
|
2024/05/21
|
11,320
|
▲
|
120
|
163,550
|
1,115
|
-691
|
-132
|
-16
|
-18
|
0
|
0
|
0
|
113
|
-210
|
12
|
-304
|
|
2024/05/20
|
11,200
|
▲
|
1,050
|
421,609
|
1,036
|
-688
|
-189
|
-16
|
-18
|
0
|
0
|
0
|
56
|
-210
|
13
|
-172
|
|
2024/05/17
|
10,150
|
▼
|
190
|
130,218
|
966
|
-645
|
-183
|
-18
|
-18
|
0
|
0
|
0
|
0
|
-146
|
9
|
-148
|
|
2024/05/16
|
10,340
|
▼
|
80
|
49,607
|
1,126
|
-805
|
-183
|
-18
|
-18
|
0
|
0
|
0
|
0
|
-146
|
11
|
-148
|
|
2024/05/14
|
10,420
|
▼
|
300
|
90,327
|
1,021
|
-775
|
-183
|
-18
|
-18
|
0
|
0
|
0
|
0
|
-146
|
11
|
-75
|
|
2024/05/13
|
10,720
|
▲
|
80
|
79,222
|
823
|
-624
|
-183
|
-18
|
-18
|
0
|
0
|
0
|
0
|
-146
|
10
|
-26
|
|
2024/05/10
|
10,640
|
▼
|
60
|
91,164
|
840
|
-637
|
-183
|
-18
|
-18
|
0
|
0
|
0
|
0
|
-146
|
6
|
-26
|
|
2024/05/09
|
10,700
|
▼
|
320
|
105,086
|
793
|
-662
|
-124
|
0
|
0
|
0
|
0
|
0
|
0
|
-125
|
7
|
-13
|
|
2024/05/08
|
11,020
|
▼
|
110
|
153,129
|
727
|
-651
|
-65
|
0
|
0
|
0
|
0
|
0
|
0
|
-65
|
3
|
-14
|
|
2024/05/07
|
11,130
|
▼
|
520
|
175,592
|
658
|
-588
|
-65
|
0
|
0
|
0
|
0
|
0
|
0
|
-65
|
-2
|
-3
|
#코아스템켐온
728x90
반응형
LIST
'한국주식' 카테고리의 다른 글
| 6/7 연기금 바이오 종목 당일 수급 현황~ (0) | 2024.06.08 |
|---|---|
| 연기금 지분율에 따른 당일 수급은 크게 의미는 없는듯하지만~ (1) | 2024.06.08 |
| 변동성 장세에 반대매매 급증…빚투 개미들 '울상' (0) | 2024.06.07 |
| 6/7 투자자별 순매수 현황 (1) | 2024.06.07 |
| 6/7 섹터별 현황 (1) | 2024.06.07 |



