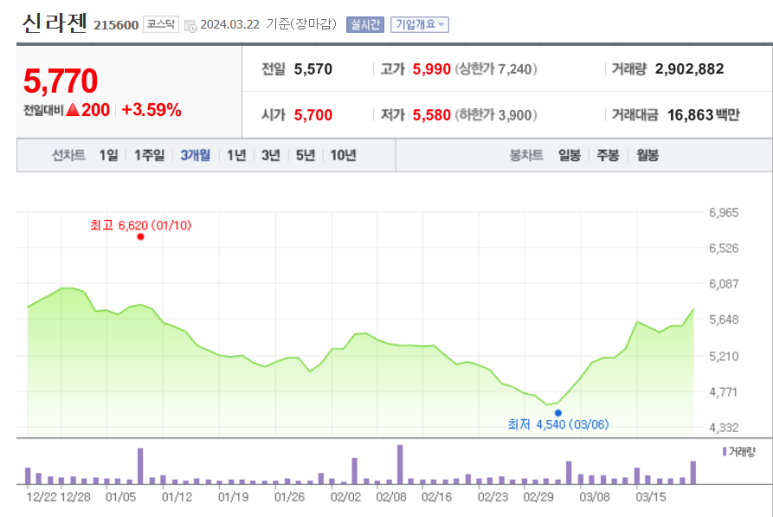
출처 : 네이버
1. 사업의 개요
가. 회사 사업 개요
당사는 항암 신약개발을 목적으로 2006년 3월에 설립된 바이오 벤처기업이며, 현재 개발 중인 항암제는 다음과 같습니다.
(1) 항암 바이러스 (Oncolytic Virus, OV)
암 치료를 목적으로 유전자를 재조합한 항암 바이러스는 우리 몸 안의 정상 세포에는피해를 주지 않으면서 암세포만을 선택적으로 감염시키고, 바이러스가 감염된 암세포를 파괴하는 동시에 우리 몸 안의 면역체계를 일깨워 면역체계 스스로 암을 치료하도록 유도하는 특징을 가지고 있습니다. 당사는 현재 항암 바이러스 단독요법뿐만 아니라 항암 바이러스와 면역관문억제제의 병용요법 등 다수의 병용요법에 대한 연구개발도 함께 진행하고 있습니다.
(2) 유사분열 체크포인트 억제제 (Mitotic Checkpoint Inhibitor, MCI)
유사분열 체크포인트(Mitotic Checkpoint)는 유핵세포의 분열 과정 중 염색체가 오류 없이 나눠지도록 감시하는 기능으로서, 매우 다양하고 복잡한 단백질들의 결합과 인산 화로 조절됩니다. 당사의 유사분열 체크포인트 억제제(MCI)는 유핵세포의 분열 과정 중 핵심적인 역할을 하는 두 가지 인산화 효소인 Threonine tyrosine kinase(TTK)와 Polo-like kinase 1(PLK1)를 저해하여 암세포의 세포 주기를 방해하고 결국 사멸에 이르게 하며, 이와 관련한 항암제 개발을 활발히 진행하고 있습니다.
본 보고서 작성기준일 현재, 당사 및 당사의 연결대상 종속회사는 항암바이러스 면역치료제를 개발하는 항암신약개발 및 Commerce 사업부문을 영위하고 있으며, 요약 재무현황은 아래와 같습니다.
[요약 연결 재무현황]
(기준일: 2023년 12월 31일)
|
(단위 : 백만원)
|
|||
|
구분
|
제18기
(2023년)
|
제17기
(2022년)
|
제16기
(2021년)
|
|
1. 연결재무내용
|
|
|
|
|
- 자산총계
|
76,715
|
103,446
|
134,828
|
|
- 부채총계
|
19,401
|
24,507
|
26,780
|
|
- 자본총계
|
57,314
|
78,939
|
108,048
|
|
- 자본금
|
51,433
|
51,433
|
51,433
|
|
2. 연결손익내용
|
|
|
|
|
- 매출액
|
3,940
|
5,013
|
254
|
|
- 영업손실
|
(21,346)
|
(24,476)
|
(20,350)
|
|
- 법인세비용차감전순손실
|
(20,181)
|
(23,901)
|
(22,124)
|
|
- 당기순손실
|
(20,369)
|
(24,593)
|
(15,656)
|
본 사업의 개요에 요약된 내용의 세부사항 및 포함되지 않은 내용 등은 'II. 사업의 내용'의 '2. 주요 제품 및 서비스'부터 '7. 기타 참고사항'까지의 항목에 상세히 기재되어 있으니 참고하여 주시기 바랍니다.
2. 주요 제품 및 서비스
당사는 본 보고서 작성기준일 현재 항암신약을 개발 중인 회사이며, 상품의 판매에 의한 매출이 별도로 존재합니다. 당사의 매출 유형은 공동연구개발 수익, 라이선스 수익 등으로 구성되어 있으며 유형별 매출은 다음과 같습니다.
(기준일 : 2023년 12월 31일) (단위: 백만원)
|
사업부문
|
매출유형
|
제18기
(2023년)
|
제17기
(2022년)
|
제16기
(2021년)
|
|
항암 바이러스를 이용한
암 치료제 개발
|
공동연구개발수익
|
-
|
-
|
13
|
|
기타수익
|
-
|
75
|
222
|
|
|
기타사업부문
|
상품 외
|
3,940
|
4,938
|
19
|
|
합 계
|
3,940
|
5,013
|
254
|
|
주) 상기 매출액은 당사의 연결 손익계산서 기준입니다.
당사는 공동연구 협약에 따라 공동협약자로부터 보전 받는 연구개발비용은 비용이 발생한 기간에 공동연구개발 수익으로 인식하고 있습니다. 라이선스 수익의 경우 라이선스 사용자가 특정 기간 동안 특정 기술을 사용할 권리를 갖는 경우에는 약정 기간 동안 정액 기준으로 수익을 인식합니다. 마일스톤 수익의 경우 각 단계별 마일스톤이 달성되는 시점에 수익으로 인식하고 있습니다.
가. 주요 제품 등의 관한 사항
[펙사벡(Pexa-Vec)]
당사가 개발 중인 펙사벡은 유전자 재조합 백시니아 바이러스를 이용한 항암제로서 다수의 고형암의 치료제로 개발 중에 있으며, 펙사벡의 디자인, 작용기전, 주요 임상결과 및 진행 현황 등은 다음과 같습니다.
(1) 개요
바이러스는 다양한 숙주세포를 감염시킨 후 그 세포 내에서 복제 및 증식하여 바이러스의 유전물질을 그 숙주세포에 전달하는 특성을 가지며, 더 나아가 그 숙주세포를 살상하는 천연적인 세포살상능력을 갖기 때문에 바이러스 유전자 조작을 통하여 정상세포에서는 증식하지 못하고 암세포에만 선택적으로 증식하는 종양 용해 바이러스를 항암제로 개발하고자 하는 노력이 있어 왔습니다. 또한, 종양 용해 바이러스의 유전자를 재조합하여 암세포 내에서 복제 및 증식한 바이러스가 면역 반응 촉진과 관련된 치료유전자를 운반하고 발현시켜 항암 면역반응 또는 암 항원 특이적 면역반응을 야기할 수 있게 됩니다. 이러한 항암제를 일컬어 항암 바이러스 면역치료제라고 명명하며, 동 항암제는 암세포만을 선택적으로 공격하여 파괴한다는 큰 장점을 가지고 있습니다.
펙사벡은 유전자 재조합 백시니아 바이러스를 이용하여 개발 중인 항암제로서 첫째 직접적인 암세포의 용해(사멸), 둘째 적응 면역반응 촉진을 통한 면역치료, 셋째 암세포 혈관의 폐쇄를 통한 종양의 사멸이라는 세 가지 작용기전을 보이는 항암 바이러스 면역치료제입니다.
(2) 디자인
펙사벡은 과거 천연두 백신으로 사용되었던 Wyeth 균주의 백시니아 바이러스를 기반으로 하여 개발되었습니다. 구체적으로, 펙사벡은 Wyeth 백시니아 바이러스가 갖는 티미딘 키나아제(Thymidine Kinase, TK) 유전자에 외래 유전자인 과립구-대식세포 콜로니 자극인자(GM-CSF) 유전자와 대장균 β-갈락토시다아제를 코딩하는 유전자를 삽입하여 제조됩니다. 펙사벡은 백시니아 바이러스의 TK 유전자가 외래 유전자의 삽입으로 인해 불활성화되어 암세포만을 선택적으로 용해시키고, 그 암세포에서 외래 유전자로 삽입된 GM-CSF 유전자를 발현시켜 인체 면역시스템의 T 세포를 활성화시킴으로써 면역기전에 의한 암 치료 효과를 나타내게 되며, β-갈락토시다아제는 펙사벡의 모니터링을 위한 마커로 삽입되었습니다.
|
|
|
펙사벡 디자인
|
(3) 작용기전
펙사벡의 대표적인 작용기전은 항암 바이러스가 암세포에서 선택적으로 증식한 후 직접적으로 종양을 용해(암세포의 사멸) 하는 것이지만, 세부적으로는 다음과 같이 3가지의 작용기전을 보이고 있습니다.
① 암 세포의 직접적 종양 용해
② 적응 면역 반응 유발
③ 종양 혈관 폐쇄
|
|
|
펙사벡 주요기전
|
첫 번째 작용기전인 '암세포의 직접적 종양 용해'는 전술한 바와 같고, 두 번째 작용기전인 '적응 면역 반응 유발'은 GM-CSF에 의하여 활성화된 면역세포가 암세포에 대한 면역반응을 일으켜 암세포의 살상을 유도하게 되는 것입니다. 두 번째 작용기전에 의거 면역치료제로서의 펙사벡의 큰 장점은 전신치료제로 기능할 수 있다는 점, 즉 면역반응이 일어나게 됨에 따라 펙사벡을 직접 투여(종양 내 주사) 하지 않은 전이된 종양도 펙사벡에 반응을 보일 수 있다는 점입니다. 당사는 펙사벡이 전신치료제로서 기능할 수 있다는 점에 기인하여 간암 외 추가 암종에 대한 개발 시 그 투여방법을 종양 내 주사가 아닌 정맥주사 방법으로 진행하였거나 진행을 계획하고 있습니다. 마지막 기전인 '종양 혈관 폐쇄' 기전은 첫 번째 기전인 직접적 종양 용해 기전에 부수되는 현상이라고 볼 수 있는데, 암세포에게 영양분을 공급하는 혈관의 종양 내피세포를 감염 및 파괴하여 펙사벡이 인근 종양세포로 더 수월하게 진입할 수 있도록 도움과 동시에 이로 인하여 혈병 생성을 유도하고 종양에 영양을 공급하는 종양 혈관을 폐쇄하여 종양의 추가적인 성장을 막는 기전입니다.
(4) 간암 대상 글로벌 임상 3상 시험(PHOCUS)
2019년 8월 2일 독립적인 데이터 모니터링 위원회(Independent Data Monitoring Commitee, DMC) 와의 펙사벡 간암 대상 임상 3상의 무용성 평가 관련 미팅에서 DMC는 당사에 임상시험 중단을 권고하였으며, 이에 따라 PHOCUS임상은 조기종료되었습니다.
(5) 주요 파이프라인
당사의 유전자 재조합 백시니아 바이러스를 이용한 항암제 개발 기술은 적응증의 확장 가능성이 기타 계열의 항암제에 비하여 월등히 우수한 것으로 판단되고, 기술의 특성 및 기 확보된 연구 데이터를 바탕으로 빠른 파이프라인 확장이 예상됩니다.
① 펙사벡의 적응증 확대
회사는 항암바이러스에 기반한 항암치료제를 개발하고 있으며, 현재 회사는 다양한 암종을 대상으로 신약후보군에 대한 임상시험 및 전임상 연구 등을 진행하고 있습니다.
② 면역항암제 등과 병용요법 개발을 통한 파이프라인 (펙사벡)
펙사벡은 간암, 대장암, 신장암, 흑색종 등을 대상으로 임상시험을 진행하였으며, 과거 다양한 임상시험 결과를 통해 항암효과를 보여주고 있습니다.
회사는 펙사벡의 간암 임상 3상 시험을 2019년 8월 조기 중단한 이후 2020년 7월 임상시험 보고서를 완성하여 각국의 규제 기관에 제출 완료하였습니다.
회사는 미국 Regeneron Pharmaceuticals, Inc. 와 2017년 5월 신세포암(신장암) 치료제 공동개발협약(Collaboration and Supply Agreement)을 체결하였습니다. 본 연구는 전이성 또는 절제 불가능한 신세포암 환자를 대상으로 펙사벡과 세미플리맙(cemiplimab, anti PD-1 저해제) 을 병용투여한 1b/2a상 임상시험입니다. 먼저 펙사벡의 투여 용량을 결정하였으며, 이후 펙사벡과 면역관문억제제의 병용요법에 대한 유효성과 안전성을 평가하였습니다.
본 연구에서 총 95명의 환자가 등록되었고 (용량 증량 단계에서 등록된 6명 환자 포함), 2023년 2월 마지막 환자의 마지막 방문을 완료하고 11월 임상시험 결과보고서(CSR) 작성을 완료하였습니다. 현재 회사는 임상시험에 참여하였던 환자들의 임상 샘플을 분석하여 반응성 예측에 도움이 될 수 있는 바이오마커를 발굴하는 등 펙사벡의 가치를 높일 수 있는 후속 연구를 진행중입니다.
한편 임상시험의 결과는 2023년 10월 유럽암학회(ESMO)에서 발표하였으며, 바이오마커 분석의 결과를 추가하여 2024년도 주요 국제암학회에서 발표할 예정입니다.
현재 회사는 본 신세포암 임상시험의 결과를 토대로 Regeneron Pharmaceuticals, Inc. 과 향후의 협력방안에 대해 논의할 계획입니다.
회사의 유럽 파트너사인 Transgene은 IIT로 유럽에서 고형암을 대상으로 펙사벡과 BMS의 여보이(Yervoy, anti CTLA-4 저해제) 병용요법 연구를 종료하였으며, 연육종과 유방암을 대상으로 Avelumab (anti PD-L1저해제)을 추가하여 메트로노믹 화학요법과 병용요법 임상시험을 진행중입니다.
한편, 회사는 펙사벡의 빠른 상업화를 위해 2020년 9월 미국 FDA로부터 흑색종에 대한 희귀의약품(Orphan drug) 지정을 승인받았습니다.
회사의 중국 파트너사인 Lee's Pharmaceutical은 2021년 8월에 중국에서 흑색종을 대상으로 펙사벡과 anti PD-L1 저해제 병용요법 임상시험을 시작하였습니다.
호주에서 진행되는 술전요법은 다기관 연구(Multi-Center Trial)로서, Royal Melbourne Hospital 포함 6개 사이트에서 전립선암을 대상으로 2상 임상시험 진행 중에 있습니다.
[신규 항암 바이러스 플랫폼 기술 (GEEV®)]
(1) 개요
의약품 정맥 주사는 경구투여가 불가능한 약물을 전신으로 빠르게 전달하기에 용이하고, 투약이 간편해 가장 선호되는 투약 방법이지만, 항암바이러스는 혈중 항바이러스 물질에 의해 상당 부분 제거되어 환부에 도달하는 약물이 제한적이기에 이를 개선할 방법이 시급한 상황입니다.
회사는 혈중 항바이러스 물질을 저해하는 단백질을 바이러스의 외피막에 직접 발현하도록 설계해 정맥으로 투여해도 항암 바이러스가 생존하게 되고, 더 많은 항암 바이러스가 종양에 도달해 높은 항암효능을 발휘하는 바이러스 플랫폼을 개발하였습니다.
2021년 2월 특허를 출원한 새로운 'GEEV® (Genetically Engineered Enveloped Virus) 플랫폼'은 정맥투여 효율을 크게 향상하고자 개발한 차세대 파이프라인 백본입니다. 회사는 서울대학교 의과대학에 위탁하여 GEEV® 기반 바이러스의 개념 증명 시험과 다양한 고형암종을 대상으로 정맥 투여 시 생체 내 항암효능평가에 대한 전임상시험을 2022년 6월에 완료하였습니다. 서울대학교와 회사의 연구 내용은 그 우수성을 인정받아 2023년 1월 미국면역항암학회(SITC) 공식 학술지인 Journal for Immunotherapy of Cancer(JITC)에 게재되었습니다.
(2) 디자인
SJ-600 Series는 Wyeth 균주의 백시니아 바이러스를 기반으로 하여 개발되었습니다. 구체적으로, Wyeth 백시니아 바이러스가 갖는 티미딘 키나아제(Thymidine Kinase, TK) 유전자에 외래 유전자인 과립구-대식세포 콜로니 자극인자(GM-CSF) 유전자와 보체조절유전자를 삽입하여 제조됩니다.
|
|
|
SJ-600 Series
|
SJ-600의 GEEV® 플랫폼은 임상 연구를 통해 안전성과 유효성이 입증된 백시니아 바이러스를 기반으로 TK 유전자 위치에 보체 조절 단백질을 삽입하여 제작하였습니다. 구체적으로는 백시니아 바이러스막 단백질 중 한가지의 세포막 관통 부위(transmembrane domain)를 CD55 유전자에 연결하여 바이러스 표면에 CD55가 발현되도록 하였습니다. 바이러스 표면에 위치한 CD55는 인체의 보체 시스템을 무력화하므로 CD55로 무장한 SJ-600 시리즈는 정맥으로 투여하여도 안정적인 항암 활성을 유지할 수 있습니다. 혈액 내에서 항암 활성이 유지되면 낮은 용량의 약물 투여로도 효능을 기대할 수 있으므로 고농도 투여에 따른 부작용을 최소화할 수 있다는 장점이 있습니다. 또한, SJ-600 시리즈는 혈류를 통한 전신투여가 가능하여 전이암까지 직접 도달하며, 심부의 암종에도 적용 가능하여 다양한 고형암종으로의 확대가 가능합니다.
(3) 차세대 항암바이러스 개발현황
당사는 현재 GEEV® 플랫폼에 다양한 효능을 가진 항암 치료유전자를 삽입하여 차세대 파이프라인 후보물질들을 다수 개발하고자 탑재할 새로운 치료유전자를 탐색 및 실험 중에 있습니다. 당사는 GEEV® 플랫폼을 이용하여 다양한 유전자가 탑재된 여러가지 파이프라인으로의 확장을 기대하고 있습니다.
[ BAL0891]
(1) 개요 및 작용기전
유사분열 체크포인트(Mitotic Checkpoint)는 유핵세포의 분열 과정 중 염색체가 오류 없이 나눠지도록 감시하는 기능으로서, 매우 다양하고 복잡한 단백질들의 결합과 인산 화로 조절됩니다. BAL0891은 그중 핵심적인 역할을 하는 Threonine tyrosine kinase(TTK)와 Polo-like kinase 1(PLK1)이라는 두 가지 인산화 효소를 저해합니다.
TTK를 저해하면 방추체 형성(spindle assembly)이 완전하지 못한 상태에서 세포가 분열되어 버리는 현상(mitotic override)이 발생합니다. 또 PLK1을 저해하면 세포 분열 단계의 중기(metaphase)에서 세포 분열 단계의 후기(anaphase)로 진행되지 못하고 G2/M에 저지되는 유사분열 차단 현상이 유도됩니다. Mitotic override 와 mitotic block은 모두 암세포의 세포 주기를 방해해 결국 사멸에 이르게 합니다. 따라서 TTK와 PLK1을 타깃으로 한 항암제 개발이 활발이 이뤄지고 있습니다.
현재 개발 중인 TTK 저해제로는 CFI-402257(Treadwell)이 임상 단계에 있으며, PLK1 저해제로는 Onvansertib 등이 임상 시험을 진행하고 있습니다. 아직까지 TTK, PLK1을 동시에 저해하는 유사분열 체크포인트 억제제(MCI)는 BAL0891이 유일한 것으로 보입니다.
두 가지 핵심적인 인산화 효소를 동시에 저해할 수 있으므로 BAL0891은 암의 성장을 강력하게 저해합니다. 현재까지 TTK 저해제 또는 PLK1 저해제가 항암제로 승인을 받은 사례는 없습니다. BAL0891가 신약으로 승인된다면 MCI 계열의 첫 번째 항암제로서, 또한 두 가지 효소를 동시에 저해하는 항암제로서 First-in-class 약물이 될 수 있습니다.
|
|
|
BAL0891의 세포 주기 방해
|
(2)유사분열 체크포인트 억제제 (BAL0891) 개발현황
BAL0891은 당사가 2022년 9월 스위스의 Basilea Pharmaceutica Ltd로부터 물질이전 계약을 통해 도입한 유사분열 체크포인트 억제제입니다. 2021년 12월 미국 FDA로부터 고형암 환자 대상 1상 임상시험에 대해 IND 승인을 득하였고, 2022년 12월 미국에서 먼저 시작하여 2023년 2월 첫 환자가 등록되었습니다.
미국 FDA에 이어 2023년 4월에는 한국 식품의약품안전처로부터 IND승인을 받았고 현재 한국 기관에서도 전이성 고형암 환자를 대상으로 환자 등록을 진행중입니다.
회사는 본 연구에서 BAL0891의 안전성을 평가하고 최대 내약 용량 및 임상 2상에 적합한 용량을 설정할 계획입니다. 단일 투여 용량 설정 및 안전성을 확인한 후에는 파클리탁셀과의 복합 투여 임상을 시작할 계획입니다.
회사는 또한 RP2D (임상 2상 권장 용량) 확립시 삼중음성유방암과 위암 환자를 대상으로 BAL0891 단독 및 파클리탁셀을 병용 투여하는 용량 확장 임상시험 또한 진행할 계획입니다. 이를 통해 기존 평가지표였던 안전성과 내약성 탐색 뿐만 아니라 유효성 또한 평가할 예정입니다.
[JX-900 Series]
(1) 차세대 항암바이러스 (JX-900) 시리즈 개요 및 개발 현황
JX-900 시리즈는 웨스턴리저브(Western Reserve) 균주를 백본으로 하는 약물이며, 그 첫번째 파이프라인으로는 종양미세환경을 악화시키는 주요 신호전달 물질을 차단하는 단백질을 발현하도록 유전자 재조합하여, 보다 향상된 항암효능을 기대할 수 있는 신규 차세대 항암바이러스를 개발 중입니다.
상기와 같은 당사의 파이프라인을 정리하면 다음과 같습니다.
[파이프라인 현황]
|
파이프라인
|
전임상
|
1상
|
2상
|
적응증
|
SIT/IIT
구분
(*1)
|
임상 수행 국가
|
협력기관
|
비 고
|
|
펙사벡
+Cemiplimab (anti PD-1 inhibitor)
|
|
|
O
|
신장암
|
SIT
|
한국,
미국, 호주
|
Regeneron Pharmaceuticals, Inc.
|
-
|
|
펙사벡
+Socazolimab (anti PD-L1 inhibitor)
|
|
O
|
O
|
흑색종
|
SIT
|
중국
|
Lee's Pharmaceuticals
|
-
|
|
펙사벡 술전요법
|
|
|
O
|
전립선암
|
IIT
|
호주
|
Royal Melbourne Hospital
|
-
|
|
SJ-600 Series
|
O
|
|
|
고형암
|
SIT
|
한국
|
서울대학교 의과대학
|
-
|
|
JX-900 Series
|
O
|
|
|
고형암
|
SIT
|
미국
|
-
|
-
|
|
BAL0891
(Mitotic checkpoint inhibitor)
|
|
O
|
|
진행성
고형암
|
SIT
|
한국
미국
|
-
|
-
|
(*1) SIT : Sponsor Initiated Trials (스폰서 주도 임상)
IIT : Investigator Initiated Trials (연구자 주도 임상)
4. 매출 및 수주상황
가. 매출실적
(기준일 : 2023년 12월 31일) (단위: 백만원)
|
사업부문
|
매출유형
|
제18기
(2023년)
|
제17기
(2022년)
|
제16기
(2021년)
|
|
항암 바이러스를 이용한암 치료제 개발
|
공동연구개발수익
|
-
|
-
|
13
|
|
기타수익
|
-
|
75
|
222
|
|
|
기타사업부문
|
상품 외
|
3,940
|
4,938
|
19
|
|
합 계
|
3,940
|
5,013
|
254
|
|
주) 상기 매출액은 당사의 연결 손익계산서 기준입니다.
당사는 본 보고서 작성기준일 현재 최종 제품에 의한 매출은 없는 상태이며, 당기 및 전기와 전전기에 인식한 매출액은 공동연구개발수익, 라이선스수익, 마일스톤수익, 기타수익 등입니다.
1. 요약재무정보
(1) 요약 연결재무정보
|
(단위 : 원)
|
|||
|
과 목
|
제 18 기
|
제 17 기
|
제 16 기
|
|
|
2023년 12월말
|
2022년 12월말
|
2021년 12월말
|
|
[유동자산]
|
52,227,813,490
|
77,818,233,094
|
122,545,268,061
|
|
현금및현금성자산
|
23,588,103,654
|
12,625,564,586
|
49,067,642,722
|
|
당기손익 공정가치 측정 금융자산
|
-
|
-
|
59,195,739,599
|
|
매출채권및기타채권
|
442,346,301
|
1,426,109,868
|
614,737,213
|
|
당기법인세자산
|
403,292,440
|
313,914,950
|
89,831,770
|
|
재고자산
|
1,212,624,693
|
779,543,777
|
-
|
|
기타유동금융자산
|
25,741,732,990
|
62,494,250,694
|
12,942,002,587
|
|
기타유동자산
|
839,713,412
|
178,849,219
|
635,314,170
|
|
[비유동자산]
|
24,487,088,619
|
25,627,828,452
|
12,282,359,529
|
|
기타포괄손익 공정가치 측정 금융자산
|
1,923,547,500
|
3,794,850,500
|
9,831,465,000
|
|
유형자산
|
908,194,038
|
899,951,584
|
952,977,601
|
|
무형자산
|
19,409,920,687
|
19,438,910,680
|
247,657,228
|
|
사용권자산
|
1,473,135,595
|
769,372,043
|
930,137,836
|
|
기타비유동금융자산
|
677,175,206
|
691,195,328
|
320,121,864
|
|
기타비유동자산
|
95,115,593
|
33,548,317
|
-
|
|
자산총계
|
76,714,902,109
|
103,446,061,546
|
134,827,627,590
|
|
[유동부채]
|
10,242,617,734
|
17,419,591,345
|
20,582,186,530
|
|
[비유동부채]
|
9,158,321,401
|
7,086,977,577
|
6,197,360,273
|
|
부채총계
|
19,400,939,135
|
24,506,568,922
|
26,779,546,803
|
|
[자본금]
|
51,433,562,500
|
51,433,562,500
|
51,433,562,500
|
|
[주식발행초과금]
|
424,658,604,278
|
424,658,604,278
|
424,658,604,278
|
|
[기타포괄손익누계액]
|
4,941,578,258
|
6,563,793,668
|
11,764,936,818
|
|
[기타자본항목]
|
15,997,915,978
|
15,631,991,520
|
14,946,308,240
|
|
[결손금]
|
(439,717,698,040)
|
(419,348,459,342)
|
(394,755,331,049)
|
|
자본총계
|
57,313,962,974
|
78,939,492,624
|
108,048,080,787
|
|
|
2023.1.1~2023.12.31
|
2022.1.1~2022.12.31
|
2021.1.1~2021.12.31
|
|
매출액
|
3,939,558,696
|
5,013,362,991
|
254,362,816
|
|
영업손실
|
(21,345,852,210)
|
(24,476,247,012)
|
(20,350,080,938)
|
|
법인세비용차감전순손실
|
(20,181,241,044)
|
(23,901,455,741)
|
(22,124,489,805)
|
|
당기순손실
|
(20,369,238,698)
|
(24,593,128,293)
|
(15,655,704,022)
|
|
기본주당손실
|
(198)
|
(239)
|
(185)
|
|
연결 종속회사의 수
|
2
|
2
|
2
|
(2) 요약 재무정보
|
(단위 : 원)
|
|||
|
과 목
|
제 18 기
|
제 17 기
|
제 16 기
|
|
|
2023년 12월말
|
2022년 12월말
|
2021년 12월말
|
|
[유동자산]
|
50,624,501,001
|
76,811,481,435
|
121,863,565,502
|
|
현금및현금성자산
|
22,207,112,943
|
11,802,190,664
|
48,607,645,901
|
|
당기손익 공정가치 측정 금융자산
|
-
|
-
|
59,195,739,599
|
|
매출채권및기타채권
|
388,373,397
|
1,422,673,587
|
516,531,577
|
|
당기법인세자산
|
403,292,440
|
313,914,950
|
89,831,770
|
|
재고자산
|
1,212,624,693
|
779,543,777
|
-
|
|
기타유동금융자산
|
25,678,548,277
|
62,461,966,011
|
12,911,801,773
|
|
기타유동자산
|
734,549,251
|
31,192,446
|
542,014,882
|
|
[비유동자산]
|
23,880,297,972
|
25,252,319,669
|
11,604,535,488
|
|
종속기업및관계기업투자
|
-
|
-
|
-
|
|
기타포괄손익 공정가치 측정 금융자산
|
1,923,547,500
|
3,794,850,500
|
9,831,465,000
|
|
유형자산
|
908,194,038
|
830,429,204
|
887,942,660
|
|
무형자산
|
19,409,920,687
|
19,438,910,680
|
247,657,228
|
|
사용권자산
|
891,991,011
|
595,247,089
|
441,480,509
|
|
기타비유동금융자산
|
651,529,143
|
559,333,879
|
195,990,091
|
|
기타비유동자산
|
95,115,593
|
33,548,317
|
-
|
|
자산총계
|
74,504,798,973
|
102,063,801,104
|
133,468,100,990
|
|
[유동부채]
|
9,472,540,836
|
19,828,351,459
|
22,016,402,795
|
|
[비유동부채]
|
8,692,811,911
|
7,086,977,577
|
5,977,812,442
|
|
부채총계
|
18,165,352,747
|
26,915,329,036
|
27,994,215,237
|
|
[자본금]
|
51,433,562,500
|
51,433,562,500
|
51,433,562,500
|
|
[주식발행초과금]
|
424,658,604,278
|
424,658,604,278
|
424,658,604,278
|
|
[기타포괄손익누계액]
|
781,485,675
|
2,464,791,021
|
7,809,991,359
|
|
[기타자본항목]
|
15,997,915,978
|
15,631,991,520
|
14,946,308,240
|
|
[이익잉여금(결손금)]
|
(436,532,122,205)
|
(419,040,477,251)
|
(393,374,580,624)
|
|
자본총계
|
56,339,446,226
|
75,148,472,068
|
105,473,885,753
|
|
종속ㆍ관계ㆍ공동기업
투자주식의 평가방법
|
원가법(*)
|
원가법(*)
|
원가법(*)
|
|
|
2023.1.1~2023.12.31
|
2022.1.1~2022.12.31
|
2021.1.1~2021.12.31
|
|
매출액
|
3,939,558,696
|
5,013,362,991
|
254,362,816
|
|
영업손실
|
(13,114,253,064)
|
(20,419,775,562)
|
(10,225,566,924)
|
|
법인세비용차감전순이익(손실)
|
(17,303,647,300)
|
(24,974,482,465)
|
(16,719,506,344)
|
|
당분기순이익(손실)
|
(17,491,644,954)
|
(25,665,896,627)
|
(16,369,126,226)
|
|
기본주당이익(손실)
|
(170)
|
(250)
|
(194)
|
(*) 다만, 간주별도실체에 해당되는 특정금전신탁에 대해서는 기업회계기준서 제1109호에 따른 방법을 선택하여 회계처리하고 있습니다.
#신라젠
#사업보고서
#바이오
'한국주식' 카테고리의 다른 글
| "순살자이가 순살자이 했네"…최근 5년간 하자 많은 건설사, GS건설 1위 (0) | 2024.03.24 |
|---|---|
| GS건설 2023년 12월 사업보고서 (1) | 2024.03.23 |
| 3/22 연기금 반도체 소재재 관련 종목 수급 현황 (1) | 2024.03.23 |
| 3/22 연기금 바이오 수급 현황 (1) | 2024.03.23 |
| 뉴지랩파마 2023년 12월 사업보고서 (1) | 2024.03.23 |



